Xây dựng nhà máy sản xuất dược phẩm: quy định an toàn mới
09:53 - 05/02/2020 1378
Vào tháng 7/2019, Quy định Quản lý và Thiết kế Xây dựng (CDM) có hiệu lực ở Việt Nam. Vì vậy, những gì các nhà sản xuất dược phẩm cần làm lên lên kế hoạch xây dựng nhà máy sản xuất dược đạt tiêu chuẩn GMP. Sau đây, Giám đốc Anh Khang M&E xin chia sẻ về quy định an toàn mới để quý khách hàng tham khảo.
Việt Nam đang dần chiếm lĩnh vị trí chiến lược trong chuỗi cung ứng điện tử thông minh toàn cầu
Việt Nam đang tập trung sản xuất thuốc biệt dược
Những phát minh đột phá trong thi công phòng sạch
Cơ hội và thách thức ngành cơ điện và phòng sạch tại Việt Nam năm 2025
Trong nhiều năm liên tiếp, sản xuất dược phẩm Việt Nam luôn phát triển ở mức 2 con số.
Thị trường dược phẩm tại Việt Nam đứng thứ 2 trong khu vực Đông Nam Á, đóng góp lớn hơn cho nền kinh tế Việt Nam hơn bất kỳ lĩnh vực nào. Tuy nhiên, tình hình sản xuất dược phẩm trong nước vẫn còn nhiều hạn chế, chỉ đáp ứng được khoảng 52,5% nhu cầu dược phẩm trong nước, số còn lại phải thông qua nhập khẩu.
Năm 2018, chi nhập khẩu dược phẩm của nước ta đạt 2.791 tỉ USD; tính đến 15/9/2019, kim ngạch nhập khẩu thuốc của Việt Nam là 2.144 tỉ USD, tăng hơn 10% so với cùng kỳ năm ngoái, tương đương con số tăng thêm khoảng 200 triệu USD.
Số liệu thống kê của Cục Quản lý Dược tính đến ngày 16/5, Việt Nam có khoảng 180 doanh nghiệp sản xuất dược phẩm và 224 cơ sở sản xuất nhà máy trong nước đạt tiêu chuẩn GMP (thực hành tốt sản xuất thuốc).
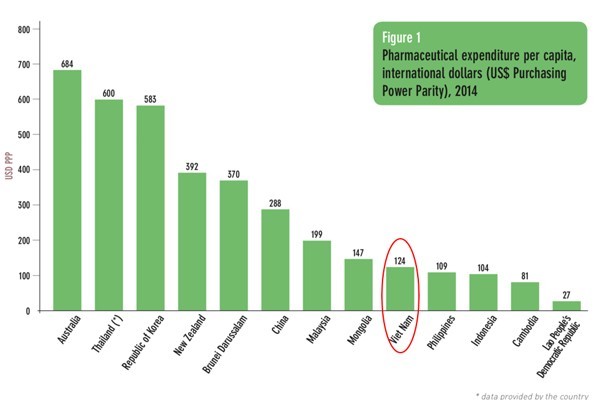
Mức chi tiêu bình quân của người dân cho thuốc ở Việt Nam (2019)
Theo Báo cáo của BMI: "Rào cản lớn nhất đối với đầu tư vốn ở Việt Nam trong vài năm qua là thiếu động lực tài chính để xây dựng các nhà máy sản xuất dược phẩm ở nước này". Tuy nhiên, dù gặp nhiều khó khăn về sản xuất và công nghệ nhưng với cơ cấu dân số trẻ nhưng đang có tốc độ già hóa nhanh, thu nhập, tình trạng ô nhiễm môi trường và mức độ quan tâm của trên 97 triệu dân đến các vấn đề sức khỏe ngày càng cao, sẽ là động lực cho ngành dược phẩm tiếp tục tăng trưởng.
Các công ty sản xuất dược phẩm hàng đầu cũng bắt đầu công bố kế hoạch mở rộng, có nghĩa là giờ đây họ sẽ thấy mình có trách nhiệm cao hơn đối với sức khỏe, an toàn và phúc lợi trong các dự án xây dựng hơn bao giờ hết do những thay đổi về quy định.
Ngành xây dựng vẫn là một trong những ngành nguy hiểm nhất, với công nhân có khả năng bị giết chết tại nơi làm việc cao gấp bốn lần so với bất kỳ ngành nào khác. Các quy định BMI, chính thức có hiệu lực vào ngày 1/7/2019, với thời hạn chuyển tiếp sáu tháng trước hạn chót, tìm cách cải thiện việc tuân thủ luật pháp về an toàn và sức khỏe thiết yếu.
Với vai trò của Điều phối viên CDM đã trở nên lỗi thời, các nhà sản xuất phải đóng vai trò giám sát trong các dự án xây dựng của họ với sự hỗ trợ của Nhà thiết kế chính (PD), có thể là một tổ chức hoặc một cá nhân chịu trách nhiệm cho giai đoạn tiền xây dựng và giám sát thiết kế và lập kế hoạch, và Nhà thầu chính (PC) của họ trong suốt dự án.
Các vai trò này bây giờ phải được điền vào nơi có nhiều hơn một nhà thầu làm việc trong một dự án, bất kể quy mô hoặc thời gian. Ban đầu, họ phải đảm bảo PD và PC có các kỹ năng, kiến thức, kinh nghiệm và khả năng tổ chức cần thiết để quản lý các rủi ro về sức khỏe và an toàn. Thông tin trước khi xây dựng phải được khách hàng tổng hợp và cung cấp cho cả hai bên, cung cấp thông tin quan trọng và có rủi ro cao, rất quan trọng trong việc cho phép họ đảm bảo các cơ sở phúc lợi có liên quan và việc sắp xếp sức khỏe & an toàn được thực hiện với các đánh giá thường xuyên khi dự án tiến triển.
Giờ đây, công việc của nhà sản xuất dược phẩm là đảm bảo PC chuẩn bị kế hoạch giai đoạn xây dựng kỹ lưỡng cho tất cả các dự án có liên quan đến việc sắp xếp các thỏa thuận về sức khỏe và an toàn, cùng với các quy tắc và biện pháp tại chỗ để kiểm soát các mối nguy và rủi ro cụ thể đối với từng dự án. Trái ngược với các quy định trước đây, CPP hiện được yêu cầu cho tất cả các dự án xây dựng - bất kể thời gian xây dựng hoặc số lượng công nhân trên công trường. Nó cũng phải được hoàn thành dù chỉ có một nhà thầu.
Các nhà sản xuất dược phẩm hiện cũng có trách nhiệm thông báo cho HSE về các dự án xây dựng lớn hơn thông qua mẫu F10 nếu dự án dự kiến kéo dài hơn 30 ngày và có hơn 20 công nhân tại chỗ một lần, hoặc sẽ vượt quá 500 ngày. Tổng cộng. Khi ngành công nghiệp dược phẩm chịu áp lực ngày càng tăng để phát triển các hợp chất mới, và vì công nghệ sản xuất phức tạp hơn được yêu cầu để đáp ứng nhu cầu này, việc thiết kế và xây dựng phòng sạch, phòng thí nghiệm và cơ sở sản xuất chắc chắn sẽ phải phát triển. Nhu cầu về các cơ sở R & D và sản xuất chuyên biệt cao hơn sẽ thấy ngày càng nhiều công ty dược phẩm muốn tiến hành các dự án xây dựng, nghĩa là điều cần thiết là họ phải tăng tốc trách nhiệm theo các quy định CDM đã sửa đổi.
Qúy khách hàng có nhu cầu Tư vấn - Thiết kế - Thi công nhà máy sản xuất dược phẩm, vui lòng liên hệ tại đây:
 | Công ty TNHH Thương mại & Kỹ thuật Anh Khang Hotline: 1900 636 814 Email: info@akme.com.vn Website: http://akme.com.vn/ Add: Số 184 Phúc Diễn, Nam Từ Liêm, Hà Nội |
Akme.com.vn






